
Protein adalah polipeptida molekul , atau terdiri dari beberapa subunit polipeptida, masing-masing yang terdiri dari rantai yang berisi urutan spesifik dari 22 asam amino proteinogenic . Perbedaannya adalah bahwa peptida pendek sedangkan polipeptida panjang. Ada beberapa konvensi yang berbeda untuk menentukan ini, yang semuanya memiliki peringatan dan nuansa.
Protein

Protein (akar kata protos dari bahasa Yunani yang berarti "yang paling utama") adalah senyawa organik kompleks berbobot molekul tinggi yang merupakan polimer dari monomer-monomer asam amino yang dihubungkan satu sama lain dengan ikatan peptida. Molekul protein mengandung karbon,hidrogen, oksigen, nitrogen dan kadang kala sulfur serta fosfor. Protein berperan penting dalam struktur dan fungsi semua sel makhluk hidup dan virus.
Kebanyakan protein merupakan enzim atau subunit enzim. Jenis protein lain berperan dalam fungsi struktural atau mekanis, seperti misalnya protein yang membentuk batang dan sendi sitoskeleton. Protein terlibat dalam sistem kekebalan (imun) sebagai antibodi, sistem kendali dalam bentuk hormon, sebagai komponen penyimpanan (dalam biji) dan juga dalam transportasi hara. Sebagai salah satu sumber gizi, protein berperan sebagai sumber asam amino bagi organisme yang tidak mampu membentuk asam amino tersebut (heterotrof).
Protein merupakan salah satu dari biomolekul raksasa, selain polisakarida, lipid, dan polinukleotida, yang merupakan penyusun utama makhluk hidup. Selain itu, protein merupakan salah satu molekulyang paling banyak diteliti dalam biokimia. Protein ditemukan oleh Jöns Jakob Berzelius pada tahun1838.
Biosintesis protein alami sama dengan ekspresi genetik. Kode genetik yang dibawa DNA ditranskripsimenjadi RNA, yang berperan sebagai cetakan bagi translasi yang dilakukan ribosom. Sampai tahap ini, protein masih "mentah", hanya tersusun dari asam amino proteinogenik. Melalui mekanisme pascatranslasi, terbentuklah protein yang memiliki fungsi penuh secara biologi.
Struktur Protein
Struktur protein dapat dilihat sebagai hirarki, yaitu berupa struktur primer (tingkat satu), sekunder (tingkat dua), tersier (tingkat tiga), dan kuartener (tingkat empat).[4] Struktur primer protein merupakan urutan asam aminopenyusun protein yang dihubungkan melalui ikatan peptida (amida). Sementara itu, struktur sekunder protein adalah struktur tiga dimensi lokal dari berbagai rangkaian asam amino pada protein yang distabilkan oleh ikatan hidrogen. Berbagai bentuk struktur sekunder misalnya ialah sebagai berikut:
- alpha helix (α-helix, "puntiran-alfa"), berupa pilinan rantai asam-asam amino berbentuk seperti spiral;
- beta-sheet (β-sheet, "lempeng-beta"), berupa lembaran-lembaran lebar yang tersusun dari sejumlah rantai asam amino yang saling terikat melalui ikatan hidrogen atau ikatan tiol (S-H);
- beta-turn, (β-turn, "lekukan-beta"); dan
- gamma-turn, (γ-turn, "lekukan-gamma").[4]
Gabungan dari aneka ragam dari struktur sekunder akan menghasilkan struktur tiga dimensi yang dinamakan struktur tersier. Struktur tersier biasanya berupa gumpalan. Beberapa molekul protein dapat berinteraksi secara fisik tanpa ikatan kovalen membentuk oligomer yang stabil (misalnya dimer, trimer, atau kuartomer) dan membentuk struktur kuartener. Contoh struktur kuartener yang terkenal adalah enzim Rubisco dan insulin.
Struktur primer protein bisa ditentukan dengan beberapa metode: (1) hidrolisis protein dengan asam kuat (misalnya, 6N HCl) dan kemudian komposisi asam amino ditentukan dengan instrumen amino acid analyzer, (2) analisis sekuens dari ujung-N dengan menggunakan degradasiEdman, (3) kombinasi dari digesti dengan tripsin dan spektrometri massa, dan (4) penentuan massa molekular dengan spektrometri massa.
Struktur sekunder bisa ditentukan dengan menggunakan spektroskopi circular dichroism (CD) dan Fourier Transform Infra Red (FTIR).[5]Spektrum CD dari puntiran-alfa menunjukkan dua absorbans negatif pada 208 dan 220 nm dan lempeng-beta menunjukkan satu puncak negatif sekitar 210-216 nm. Estimasi dari komposisi struktur sekunder dari protein bisa dikalkulasi dari spektrum CD. Pada spektrum FTIR, pita amida-I dari puntiran-alfa berbeda dibandingkan dengan pita amida-I dari lempeng-beta. Jadi, komposisi struktur sekunder dari protein juga bisa diestimasi dari spektrum inframerah.
Struktur protein lainnya yang juga dikenal adalah domain. Struktur ini terdiri dari 40-350 asam amino. Protein sederhana umumnya hanya memiliki satu domain. Pada protein yang lebih kompleks, ada beberapa domain yang terlibat di dalamnya. Hubungan rantai polipeptida yang berperan di dalamnya akan menimbulkan sebuah fungsi baru berbeda dengan komponen penyusunnya. Bila struktur domain pada struktur kompleks ini berpisah, maka fungsi biologis masing-masing komponen domain penyusunnya tidak hilang. Inilah yang membedakan strukturdomain dengan struktur kuartener. Pada struktur kuartener, setelah struktur kompleksnya berpisah, protein tersebut tidak fungsional.
Asam Amino

asam amino adalah sembarang senyawa organik yang memiliki gugus fungsional karboksil (-COOH) dan amina (biasanya -NH2). Dalambiokimia seringkali pengertiannya dipersempit: keduanya terikat pada satu atom karbon (C) yang sama (disebut atom C "alfa" atau α). Gugus karboksil memberikan sifat asam dan gugus amina memberikan sifat basa. Dalam bentuk larutan, asam amino bersifat amfoterik: cenderung menjadi asam pada larutan basa dan menjadi basa pada larutan asam. Perilaku ini terjadi karena asam amino mampu menjadi zwitter-ion. Asam amino termasuk golongan senyawa yang paling banyak dipelajari karena salah satu fungsinya sangat penting dalam organisme, yaitu sebagai penyusun protein.
Struktur asam amino
Struktur asam amino secara umum adalah satu atom C yang mengikat empat gugus: gugus amina (NH2), guguskarboksil (COOH), atom hidrogen (H), dan satu gugus sisa (R, dari residue) atau disebut juga gugus atau rantai samping yang membedakan satu asam amino dengan asam amino lainnya.
Atom C pusat tersebut dinamai atom Cα ("C-alfa") sesuai dengan penamaan senyawa bergugus karboksil, yaitu atom C yang berikatan langsung dengan gugus karboksil. Oleh karena gugus amina juga terikat pada atom Cαini, senyawa tersebut merupakan asam α-amino.
Asam amino biasanya diklasifikasikan berdasarkan sifat kimia rantai samping tersebut menjadi empat kelompok. Rantai samping dapat membuat asam amino bersifat asam lemah, basa lemah, hidrofilik jika polar, dan hidrofobik jika nonpolar.
Isomerisme pada asam amino

Karena atom C pusat mengikat empat gugus yang berbeda, maka asam amino—kecuali glisina—memilikiisomer optik: l dan d. Cara sederhana untuk mengidentifikasi isomeri ini dari gambaran dua dimensi adalah dengan "mendorong" atom H ke belakang pembaca (menjauhi pembaca). Jika searah putaran jarum jam (putaran ke kanan) terjadi urutan karboksil-residu-amina maka ini adalah tipe d. Jika urutan ini terjadi dengan arah putaran berlawanan jarum jam, maka itu adalah tipe l. (Aturan ini dikenal dalam bahasa Inggris dengan nama CORN, dari singkatan COOH - R - NH2).
Pada umumnya, asam amino alami yang dihasilkan eukariota merupakan tipe l meskipun beberapa siput laut menghasilkan tipe d. Dinding sel bakteri banyak mengandung asam amino tipe d
Polimerisasi asam amino

Protein merupakan polimer yang tersusun dari asam amino sebagaimonomernya. Monomer-monomer ini tersambung dengan ikatan peptida, yang mengikat gugus karboksil milik satu monomer dengan gugus amina milik monomer di sebelahnya. Reaksi penyambungan ini (disebut translasi) secara alami terjadi di sitoplasma dengan bantuan ribosom dan tRNA.
Pada polimerisasi asam amino, gugus -OH yang merupakan bagian gugus karboksil satu asam amino dan gugus -H yang merupakan bagian gugus amina asam amino lainnya akan terlepas dan membentuk air. Oleh sebab itu, reaksi ini termasuk dalam reaksi dehidrasi. Molekul asam amino yang telah melepaskan molekul air dikatakan disebut dalam bentuk residu asam amino.
Zwitter-ion
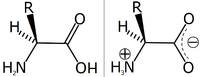
Karena asam amino memiliki gugus aktif amina dan karboksil sekaligus, zat ini dapat dianggap sebagai sekaligus asam dan basa (walaupun pH alaminya biasanya dipengaruhi oleh gugus-R yang dimiliki). Pada pH tertentu yang disebut titik isolistrik, gugus amina pada asam amino menjadi bermuatan positif (terprotonasi, –NH3+), sedangkan gugus karboksilnya menjadi bermuatan negatif (terdeprotonasi, –COO-). Titik isolistrik ini spesifik bergantung pada jenis asam aminonya. Dalam keadaan demikian, asam amino tersebut dikatakan berbentuk zwitter-ion. Zwitter-ion dapat diekstrak dari larutan asam amino sebagai struktur kristal putih yang bertitik lebur tinggi karena sifat dipolarnya. Kebanyakan asam amino bebas berada dalam bentuk zwitter-ion pada pH netral maupun pH fisiologis yang dekat netral.
Ninhidrin


Ninhidrin (2,2-Dihydroxyindane-1 ,3-dion) adalah suatu bahan kimia yang digunakan untuk mendeteksi amonia atau primer dan sekunder amina . Ketika bereaksi dengan amina bebas, warna biru atau ungu dalam dikenal sebagai Ruhemann's ungu adalah berkembang. Ninhidrin ini paling sering digunakan untuk mendeteksi sidik jari , sebagai amina tersisa dari peptida dan protein ( terminal amina atau lisin residu) sloughed off di sidik jari bereaksi dengan ninhidrin.
Reaktifitas
atom karbon dari karbonil beruang muatan positif parsial ditingkatkan dengan gugus penarik elektron tetangga seperti karbonil sendiri. Jadi pusat karbon dari senyawa 1,2,3-tricarbonyl jauh lebih elektrofilik dari satu dalam keton sederhana. Jadi indane-1 ,2,3-trione mudah bereaksi dengan nukleofil, termasuk air. Sedangkan untuk senyawa karbonil yang paling, bentuk karbonil lebih stabil dari produk penambahan air (hydrate), ninhidrin membentuk hidrat stabil dari karbon pusat karena efek destabilisasi kelompok karbonil berdekatan.
Catatan bahwa untuk menghasilkan ninhidrin kromofor , amina tersebut terkondensasi dengan molekul ninhidrin untuk memberikan dasar Schiff. Dengan demikian hanya amonia dan amina primer dapat melanjutkan masa lalu langkah ini. Pada langkah ini, ada juga harus menjadi proton alfa (* H dalam diagram) untuk transfer basis Schiff, jadi amina sebuah berdekatan dengan karbon tersier tidak dapat dideteksi oleh tes ninhidrin. Reaksi dengan amina sekunder ninhidrin memberikan garam iminium, yang juga berwarna, dan ini biasanya kuning-jingga dalam warna.

Beberapa Istilah
- Sebuah polipeptida merupakan rantai linear asam amino tunggal.
- Sebuah protein adalah satu atau lebih polipeptida lebih dari sekitar 50 asam amino yang panjang.
- Sebuah oligopeptide atau (hanya) sebuah peptida adalah polipeptida kurang dari 30-50 asam amino panjang.
- Sebuah dipeptida memiliki dua asam amino.
- Sebuah tripeptide memiliki tiga asam amino.
- Sebuah tetrapeptide memiliki empat asam amino.
- Sebuah pentapeptide memiliki lima asam amino.
- Sebuah octapeptide memiliki delapan asam amino (misalnya, angiotensin II ).
- Sebuah nonapeptide memiliki sembilan asam amino (misalnya oksitosin ).
- Sebuah decapeptide telah sepuluh asam amino (misalnya, gonadotropin-releasing hormone & angotensin I ).
- Sebuah neuropeptide adalah peptida yang aktif dalam asosiasi dengan jaringan saraf.
- Sebuah hormon peptida adalah peptida yang berfungsi sebagai hormon.
- Sebuah proteose adalah campuran peptida yang dihasilkan oleh hidrolisis protein. Istilah ini agak kuno.










